肺腺癌,肺腺癌原因,肺腺癌症狀,肺腺癌檢查,肺腺癌治療,肺腺癌存活率
目录
肺腺癌是什麼?原因、症狀、檢查、治療及存活率,這些都是大家需要了解的重要問題。肺腺癌是一種常見肺癌類型,原因可能包括長期吸菸、空氣污染等。症狀有咳嗽、胸痛、呼吸困難等,檢查方法有低劑量CT、PET-CT等。治療方式包括手術、化療、標靶治療等,存活率因發現早晚和治療方式而異。
肺腺癌的定義與流行病學
肺腺癌屬於上皮性惡性腫瘤,起源於支氣管黏膜的腺體細胞或肺泡上皮細胞,具有明確的腺體分化特徵。根據2015年世界衛生組織(WHO)肺腫瘤分類標準,肺腺癌可進一步細分為原位腺癌(AIS)、微浸潤性腺癌(MIA)和浸潤性腺癌等亞型。
流行病學數據顯示,肺腺癌的發病率存在明顯的地理差異,亞洲地區尤其是東亞國家的發生率高於西方國家。值得注意的是,近年來肺腺癌的發病年齡有年輕化趨勢,且女性患者的比例相對高於其他肺癌類型,這可能與特定的分子致病機制有關。
肺腺癌原因與風險因子
肺腺癌的發生是多因素共同作用的結果,主要包括以下幾方面:
主要風險因子
吸煙雖是肺癌最重要的風險因子,但與鱗狀細胞癌相比,肺腺癌與吸煙的關聯性相對較低。約15-20%的肺腺癌患者從無吸煙史,這在女性患者中尤為明顯。現有研究顯示,被動吸煙(二手煙)暴露與肺腺癌風險增加有顯著相關性,其風險比(OR值)約為1.3-1.5。
環境與職業暴露
多種環境污染物已被證實與肺腺癌發生相關,包括石棉、氡氣、重金屬(如砷、鎘、鉻)以及多環芳烴等化學物質。其中氡氣暴露被認為是繼吸煙之後第二大的肺腺癌致病因素,長期暴露於高濃度氡氣環境可使肺癌風險增加8-16%。
遺傳與分子機制
分子流行病學研究發現,EGFR、KRAS、ALK等驅動基因的突變在肺腺癌發生中起關鍵作用。亞洲非吸煙女性肺腺癌患者中EGFR突變率高達50-60%,遠高於西方人群的10-15%。此外,家族史也是重要風險因子,一級親屬罹患肺癌者,其肺腺癌風險增加2-3倍,這可能與遺傳性DNA修復基因多態性有關。
其他相關因素
慢性肺部疾病(如COPD、肺纖維化)、HIV感染以及飲食因素(低蔬果攝取、高脂肪飲食)也被認為可能增加肺腺癌風險。近年研究還發現,空氣細懸浮微粒(PM2.5)長期暴露與肺腺癌發生率呈正相關,其機制可能涉及慢性炎症反應和氧化壓力。
肺腺癌症狀表現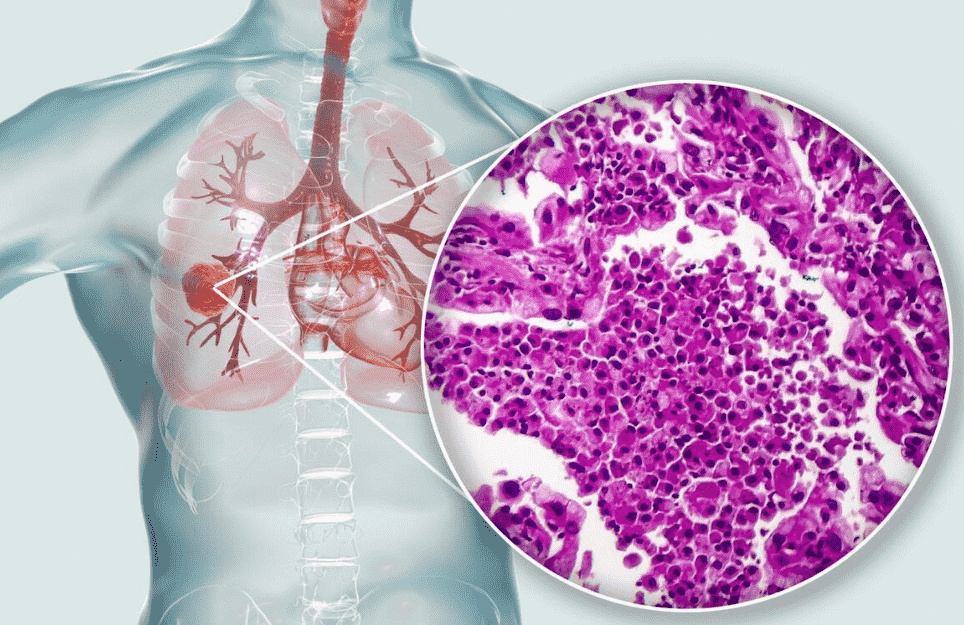
肺腺癌的臨床表現具有高度異質性,從無症狀到嚴重呼吸衰竭均可能出現,這與腫瘤位置、大小、生長速度和轉移情況密切相關。臨床症狀大致可分為以下幾類:
原發性症狀
咳嗽是最常見的首發症狀(約50-75%),通常表現為持續性乾咳或咳少量黏液痰。當腫瘤侵犯支氣管黏膜時,可能出現咳血(30-50%),典型表現為痰中帶血絲。胸痛(30-45%)多為鈍痛或刺痛,隨呼吸加重。值得注意的是,約10-15%的周圍型肺腺癌早期可完全無症狀,僅在影像學檢查時偶然發現。
局部侵犯症狀
腫瘤侵犯縱膈可能引起聲音嘶啞(喉返神經壓迫)、吞嚥困難(食道壓迫)或上腔靜脈症候群(面部水腫、頸靜脈怒張)。侵犯胸膜可導致頑固性胸水和胸膜痛。肺尖部腫瘤(Pancoast tumor)可能表現為肩部放射痛和Horner症候群(眼瞼下垂、瞳孔縮小)。
轉移性症狀
腦轉移(約20-40%)可表現為頭痛、噁心嘔吐、癲癇或局灶性神經缺損。骨轉移(30-40%)多引起劇烈疼痛和病理性骨折。肝轉移可能導致黃疸和肝功能異常。腎上腺轉移通常無症狀,但大體積轉移可能引起腹痛。
副腫瘤症候群
肺腺癌較其他肺癌類型更易伴發副腫瘤症候群,包括高鈣血症(PTHrP分泌)、抗利尿激素不當分泌症候群(SIADH)和類癌症候群等。約5-10%患者可能出現杵狀指或增生性骨關節病變。
肺腺癌檢查
肺腺癌的診斷需結合影像學、病理學和分子檢測進行綜合評估,具體包括以下步驟:
影像學檢查
胸部X光片可發現多數中央型腫瘤,但對小於1cm的周圍型病變敏感度低。胸部電腦斷層(CT)是首選檢查方式,可評估腫瘤大小、位置及縱膈淋巴結狀態。典型肺腺癌CT表現為周圍型毛玻璃樣結節(GGO)或實性結節伴胸膜凹陷徵。正子斷層掃描(PET-CT)對分期和轉移灶檢測有重要價值,標準攝取值(SUV)通常大於2.5。
病理學診斷
組織採檢方式包括支氣管鏡活檢(中央型病變)、CT引導經皮穿刺(周圍型病變)和胸腔鏡手術切除。病理學特徵包括腺泡狀、乳頭狀、微乳頭狀或實性生長模式,腫瘤細胞常表達TTF-1和Napsin A等標記物。2011年國際肺癌研究協會(IASLC)提出的新分類強調了病理亞型對預後的預測價值。
分子檢測
根據最新NCCN指南,所有轉移性肺腺癌均應進行EGFR、ALK、ROS1、BRAF、KRAS、MET、RET、HER2等驅動基因檢測。檢測方法包括免疫組織化學(IHC)、螢光原位雜交(FISH)和次世代定序(NGS)。液體活檢(ctDNA)在監測治療反應和耐藥突變方面具有潛在優勢。
分期評估
採用第8版TNM分期系統,需綜合胸部CT、腹部影像、腦部MRI和骨掃描結果。對於疑似III期以上患者,應考慮內視鏡超音波(EBUS)或縱膈鏡進行淋巴結分期。
肺腺癌治療策略
肺腺癌的治療需根據分期、分子特徵和患者狀態制定個體化方案:
手術治療
I-II期和部分IIIA期患者首選解剖性肺切除(肺葉切除或亞肺葉切除)加系統性淋巴結清掃。視頻輔助胸腔鏡手術(VATS)因其創傷小、恢復快已成為標準術式。術前應評估肺功能和心肺儲備,術後5年存活率IA期可達85-90%,IB期約65-75%。
放射治療
立體定向體部放射治療(SBRT)是無法手術早期患者的重要選擇,局部控制率達85-95%。對於III期不可切除患者,同步放化療(如順鉑+依托泊苷)後免疫維持治療已成新標準。全腦放射治療(WBRT)用於多發腦轉移,而單發轉移可考慮立體定向放射手術(SRS)。
全身性治療
針對驅動基因陽性患者,標靶治療顯著改善預後:EGFR突變首選奧希替尼(osimertinib),ALK重排使用阿來替尼(alectinib),ROS1重排則用克唑替尼(crizotinib)。免疫檢查點抑制劑(如pembrolizumab)用於PD-L1高表達(≥50%)且無驅動基因患者,聯合化療可提高反應率。
支持性治療
包括疼痛控制(WHO三階梯療法)、惡病質管理(營養支持+孕酮衍生物)和心理社會支持。對於EGFR TKI相關皮疹可使用四環素類抗生素和局部類固醇。免疫治療相關不良事件需早期識別並使用高劑量類固醇。
肺腺癌存活率與預後因子
肺腺癌的預後與分期、分子特徵和治療反應密切相關:
分期相關存活率
根據SEER資料庫最新統計,5年相對存活率分別為:局限期(I-II期)60-80%,區域轉移(III期)25-40%,遠處轉移(IV期)5-10%。值得注意的是,接受根治性手術的IA期微乳頭狀亞型患者復發風險顯著高於其他亞型,5年無復發存活率僅60-70%。
分子標記與預後
EGFR外顯子19缺失突變患者對TKI反應優於L858R點突變,中位無惡化存活期(PFS)分別為18.9 vs 12.5個月。ALK重排患者接受二代ALK抑制劑治療,中位總存活期(OS)可超過5年。相反,KRAS突變和STK11共突變與免疫治療原發性耐藥相關。
其他預後因子
體能狀態(ECOG評分)、乳酸脫氫酶(LDH)水平、中性球淋巴球比(NLR)和腫瘤突變負荷(TMB)均被證實具有預後價值。近年研究發現,循環腫瘤細胞(CTC)數量和腫瘤浸潤淋巴細胞(TILs)密度也與治療反應相關。
復發監測
術後2年內每3-6個月追蹤一次,包括胸部CT和腫瘤標記物(如CEA)。對於接受標靶治療患者,應監測血漿ctDNA動態變化以早期發現耐藥突變(如EGFR T790M)。
新興研究方向與展望
肺腺癌研究領域近年取得重大進展,以下方向特別值得關注:
精準醫學進展
第三代EGFR TKI克服T790M耐藥後,針對C797S等三級突變的新藥開發如火如荼。抗體藥物複合體(ADC)如patritumab deruxtecan在HER3過表達患者展現45%反應率。雙特異性抗體和汎KRAS抑制劑早期臨床結果也令人振奮。
免疫治療突破
新型免疫檢查點(如TIGIT、LAG-3)抑制劑聯合PD-1/PD-L1抗體的臨床試驗正在進行。腫瘤疫苗(如EGFRvIII疫苗)和CAR-T細胞治療在特定亞群顯示潛力。微生物組調控(糞菌移植)可能改善免疫治療反應率。
早期檢測技術
低劑量CT篩查在高風險族群(如55-74歲有30包年吸煙史者)可降低20%肺癌死亡率。液體活檢技術如CancerSEEK可在症狀出現前4年檢測到肺癌信號。呼氣揮發性有機化合物(VOC)分析也展現診斷潛力。
肺腺癌作為高度異質性的疾病,其診療已進入分子分型指導的精准醫學時代。通過多學科團隊合作,結合手術、放射治療、標靶藥物和免疫治療的綜合策略,患者預後顯著改善。未來研究應著重於早期檢測技術、耐藥機制克服和個體化治療策略優化,以進一步提高患者存活率和生活品質。
發佈留言